小鼠胚胎發育由合子開始,經過2細胞♠︎、4細胞👌🏿、8細胞和桑椹胚形成囊胚,之後繼續發育形成胚內和胚外組織。具有最高潛能的幹細胞被稱為全能性幹細胞,一般指體內的合子🐓,2/4細胞,它可以發育到胚內和胚外組織。多能性幹細胞一般來源於囊胚的內細胞團,其發育潛能受限,只能發育到胚內組織。1981年,人們首次在體外分離了第一株小鼠多能性胚胎幹細胞系(ESC)🧘🏽♂️9️⃣。直到40年後的今天,所有培養的小鼠胚胎幹細胞都處於多能狀態,人們一直致力於在體外建立發育潛能更高的幹細胞。表達全能性基因Zscan4s和Mervl的2C-like細胞是最早報道的能夠產生胚內和胚外組織的細胞[1]。但是,2C-like細胞在培養基中是亞穩態的,僅以極低的百分比(0.1%-1%)存在。2017年😽🚺,兩個研究小組報道使用不同的化學小分子混合物建立了擴展型多能幹細胞(Expanded (or extended) pluripotent stem cell🌚✍️,EPSC),具有胚內和胚外雙向分化潛能[2, 3]。但是🏂🏼,這種擴展型多能性幹細胞的分子特征和功能等方面與體內真正的全能性胚胎細胞仍存在較大差距[4]。迄今為止,人們仍無法在體外捕獲和維持分子和功能上與體內全能性胚胎相似的全能性幹細胞⛹🏻♀️,因此也就無法真正利用體外細胞培養體系研究著床前胚胎發育過程,並且導致胚外組織的體外分化及相關轉化醫學應用等方面也存在極大的局限性。
2021年5月14日,意昂体育平台生命科學學院/意昂体育-清華生命科學聯合中心杜鵬研究員課題組在Cell雜誌在線發表了題為“Mouse totipotent stem cells captured and maintained through spliceosomal repression”的研究論文。在這項研究中🖕🏿,作者通過抑製剪接體,實現了小鼠全能性幹細胞的體外建立和培養,且這種細胞在分子和功能上接近體內2細胞和4細胞時期胚胎,因此被命名為totipotent blastomere-like cells(TBLCs)🚁。

論文截圖
在本研究工作中,作者主要有以下發現:
剪接體抑製驅動多能幹細胞到全能幹細胞的轉變
作者分析了先前發表的單細胞胚胎數據,發現剪接因子在早期胚胎發育中是動態變化的,有一類剪接因子在胚胎發育早期低表達🐂,在後期表達量逐漸升高。作者發現敲低這一類關鍵剪接因子能廣泛激活全能性基因(如Zscan4s🕳、Plk2👩🏿⚖️、Btg1/2以及轉座子Mervl和Mt2),沉默多能性基因(如Utf1🧬、Tdgf1、Sox2),將小鼠多能性的ESC重編程為全能性狀態。同時🧑🏻🦲,將剪接抑製劑Pladienolide B(PlaB)添加到Serum/ LIF培養基中(SLP培養基),能夠在體外培養和維持TBLC,且細胞活性和核型正常。與PSCs (pluripotent stem cells) (P0)相比,在SLP培養基中培養5代之後,整體轉錄組趨於穩定🗑,特異性表達胚胎時期的全能性基因👨🏿🏫,沉默囊胚時期特異性表達的多能性標記基因,接近體內胚胎的2細胞和4細胞時期(圖1)。其次他們發現撤去PlaB後,TBLCs細胞能夠轉換到多能性狀態(圖1),說明單個剪接抑製劑PlaB可以操縱這個多能/全能幹細胞轉換過程。SLP培養條件提供了一個可靠的體外系統來研究全能到多能細胞的轉換✋,且這個系統在分子水平上能夠模擬從體內2細胞時期到囊胚時期的發育。
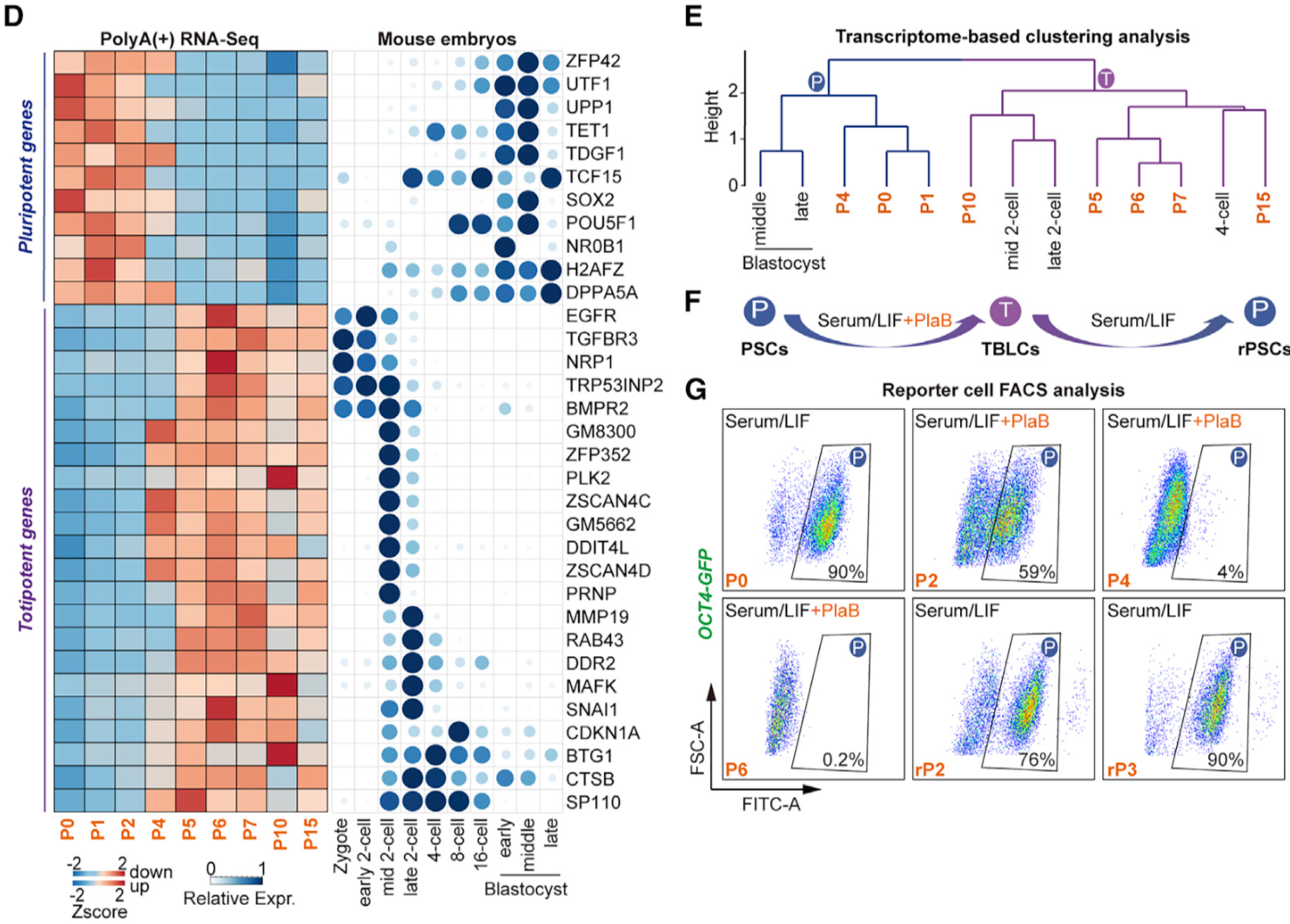
圖1 TBLC轉錄組穩定👨🏼🔬,且接近體內2細胞和4細胞時期胚胎
TBLC在單細胞轉錄組🧔🏿、翻譯組、DNA甲基化組和染色質可及性上具有與2細胞和4細胞時期相似的分子特征
作者對PSCs和TBLCs進行了單細胞轉錄組測序🈯️,使用23個多能性標記基因和30個全能性基因以及轉座子Mervl和Mt2,區分了PSC和TBLC,發現幾乎所有的TBLC來自SLP培養基,說明SLP培養基能培養和維持TBLC細胞的同質性(圖2)6️⃣。此外🤌🏽,翻譯組測序(Ribosomal profiling🛢,Ribo- seq)顯示⛑,與PSCs相比🈷️,TBLCs在翻譯組水平上全能性基因表達上調🚣🏿♂️,多能性標記基因表達下調。作者使用全基因組亞硫酸氫鹽測序法(Whole-Genome Bisulfite Sequencing,WGBS)來表征PSCs和TBLCs的DNA甲基化組👨🎓,發現PSCs中的整體甲基化水平為71%,接近E6.5-E7.5時期胚胎;而TBLCs與之相比甲基化水平大幅降低至35%👩✈️,類似於體內2細胞和4細胞胚胎(整體甲基化程度分別為47%和41%)🍣。染色質可及性測序ATAC-seq(Assay for Transposase-Accessible Chromatin using sequencing)結果顯示,與PSCs相比,TBLCs在轉錄起始位點(TSS)附近的開放峰和封閉峰與小鼠2細胞和4細胞胚胎時期顯示出相似的開放或封閉狀態,這意味著TBLCs具有與早期胚胎相似的染色質可及性。綜上,作者使用單細胞測序以及多組學分析,表征了與體內全能性胚胎相似的TBLCs在轉錄組,DNA甲基化組👩🏽💼,染色質可及性和翻譯組上的分子特征。
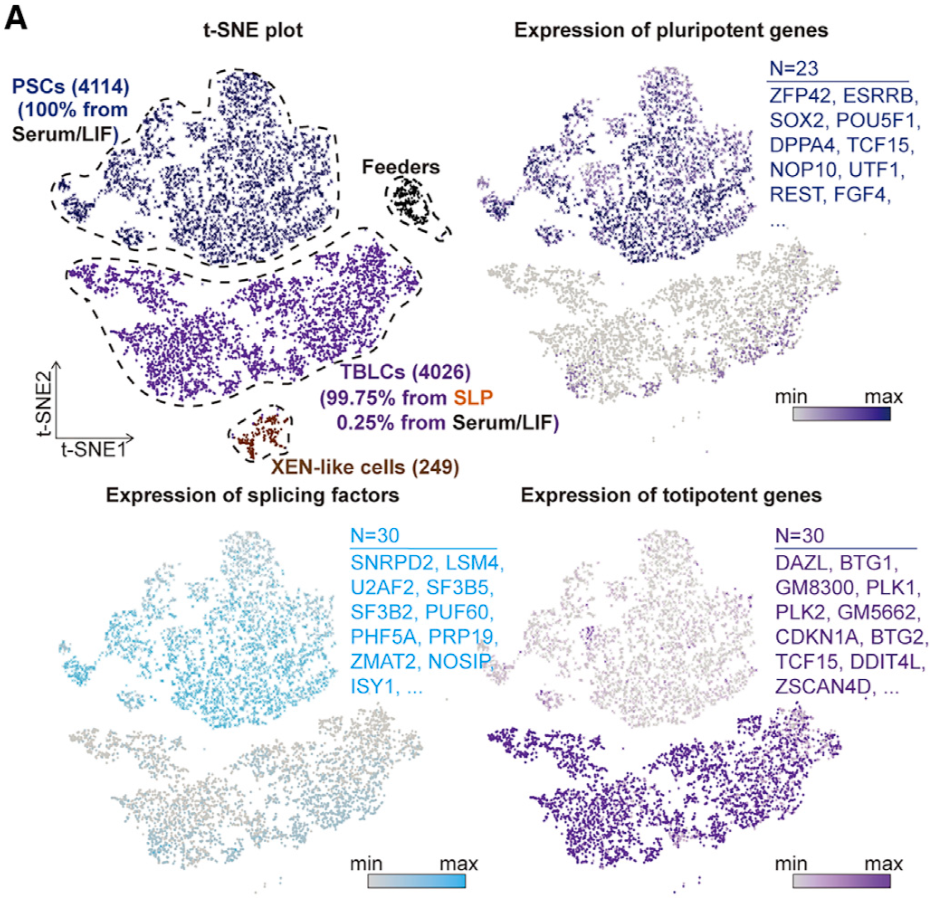
圖2 SLP培養基能培養和維持TBLC細胞的同質性
TBLC與EPSCs和2C-like細胞不同👳🏿♂️,在分子水平上靠近2細胞和4細胞時期胚胎
此外💆🏽,作者比較了TBLCs與已發表的EPSCs和2C-like細胞的轉錄組測序數據👙,發現與TBLCs細胞中大多數多能性標記基因被廣泛沉默不同📺,EPSCs仍明顯表達多能性標記基因🤦🏿♂️;而在TBLCs中高表達的全能性基因或轉座子在EPSCs中表達量很低。作者對TBLCs和EPSCs與小鼠植入前胚胎數據進行了基於轉錄組的主成分分析以及與2C-like細胞的相關性分析(圖3)🕧,發現TBLCs明顯靠近2細胞和4細胞時期胚胎,EPSCs和2C-like細胞接近多能性囊胚時期,這與最近一個研究組得到的結論一致[4]。
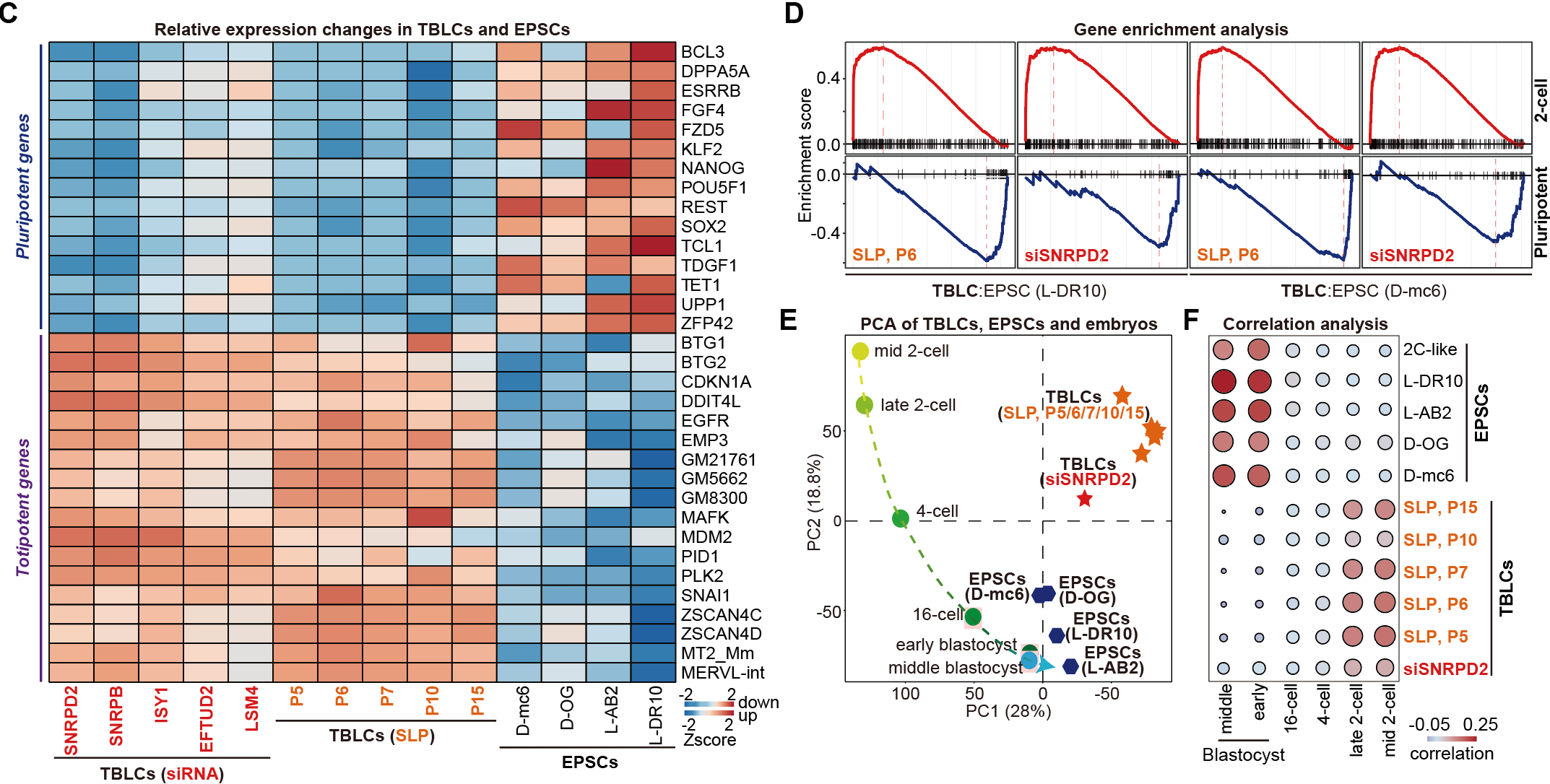
圖3 TBLC與EPSC和2C-like細胞不同,更接近2細胞和4細胞時期胚胎
TBLC具有雙向分化潛能,能夠產生多種胚內和胚外細胞譜系
作者進行的功能嵌合實驗表明🏋🏼♂️,TBLC具有強大的雙向發育潛能🏨,可以產生胚內和胚外組織,包括囊胚時期的TE,E6.5-E7.5胚胎的EPC和ExE🤾🏻♀️,以及發育後期的胎盤和卵黃囊。更重要的是,作者還觀察到來源於單個TBLC的熒光標記細胞可以嵌合進入整個E6.5-E7.5胚胎,包括EPI😄、ExE和EPC(圖4)。小鼠胎盤是一個富含血液的復雜器官,為了避免免疫染色產生的假陽性✒️,作者將E13.5嵌合小鼠的胎盤和卵黃囊消化成單細胞✬,並通過流式富集篩選出有熒光標記的TBLC來源的細胞進行單細胞測序,發現其能夠在小鼠體內分化為至少6種胚外和15種胚內細胞類型。本篇文章首次利用單細胞轉錄組準確追蹤出供體細胞的發育譜系,為全能性細胞的功能性檢驗提供了一個更嚴格的檢驗方法。作者使用單細胞測序☕️,證明了TBLC能夠在胎盤和卵黃囊中分化為至少6種胚外和15種胚內細胞類型(圖5)。
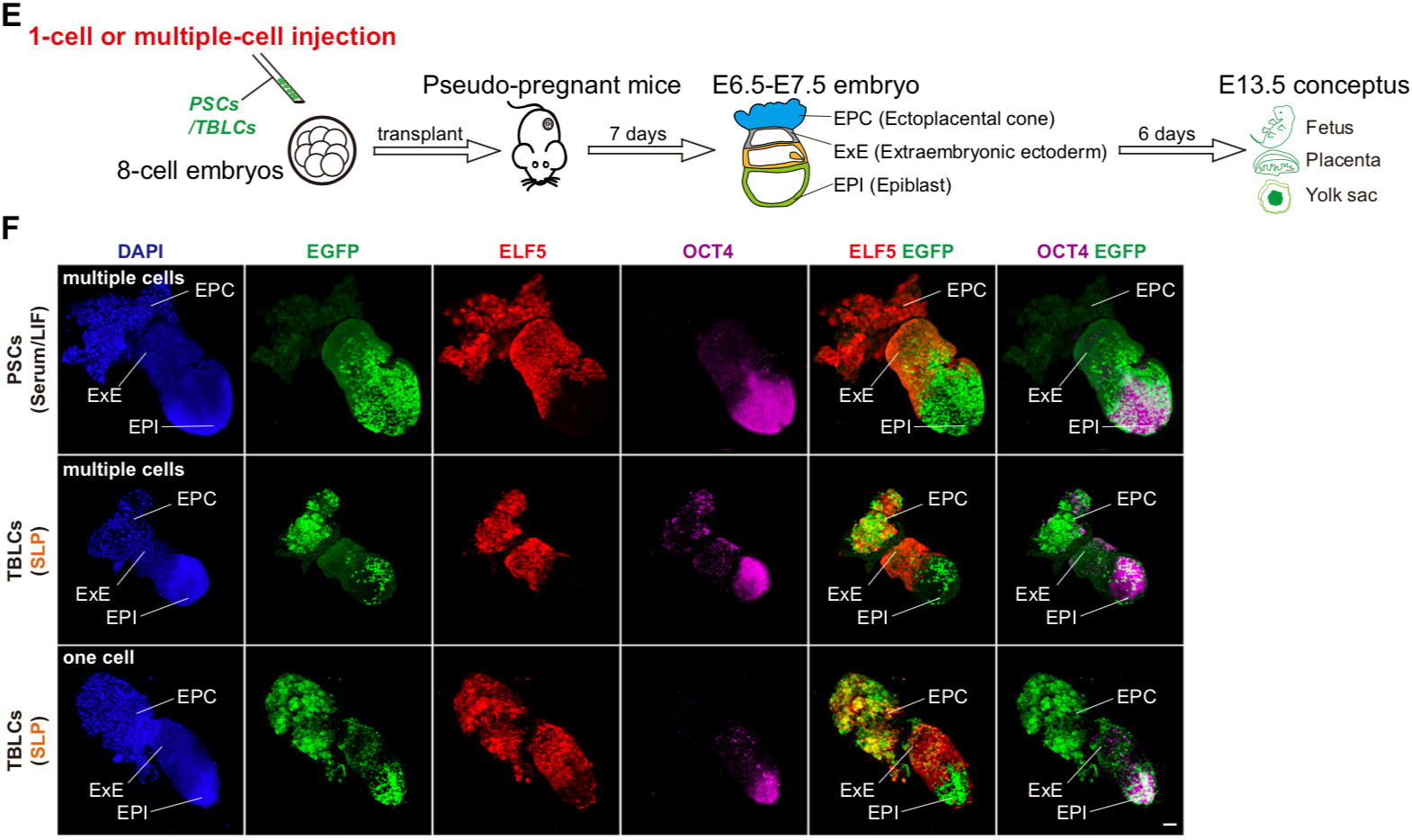
圖4 TBLC在E6.5-E7.5的嵌合胚胎中能分化到胚內和胚外組織
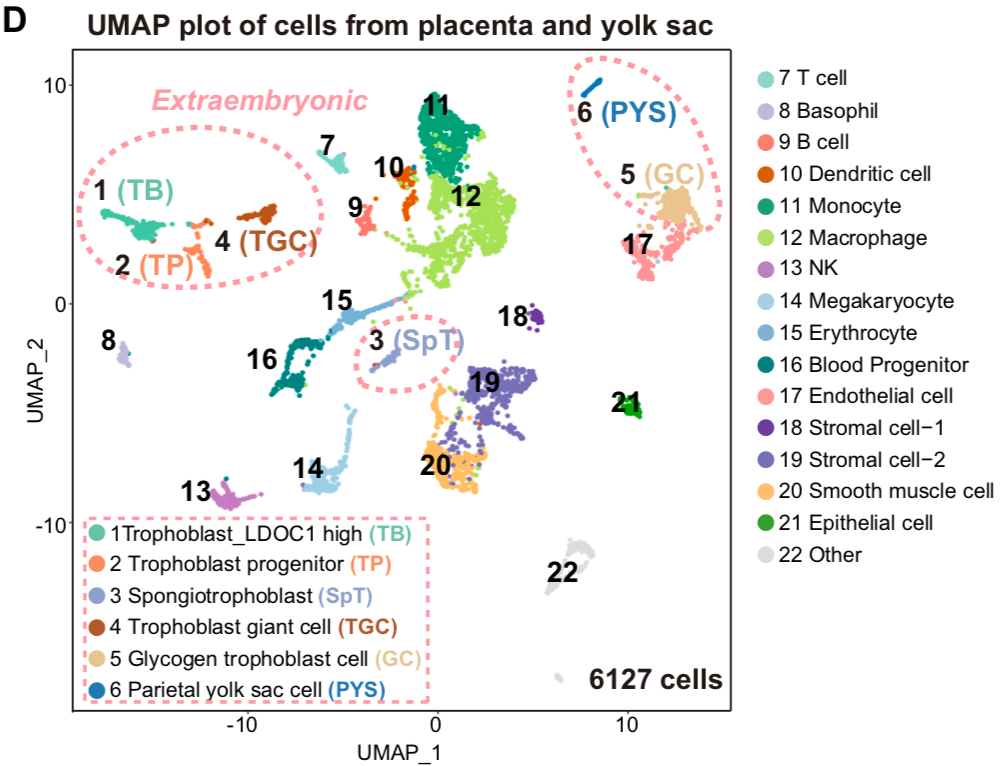
圖5 單細胞水平上鑒定TBLCs能夠分化到多個胚內和胚外細胞譜系
作者發現🧖,在小鼠胚胎幹細胞中,動態剪接體阻遏導致了廣泛的內含子積累🌦,從而導致多能性基因表達下降👼🏽,而全能性基因仍然可以被有效地剪接並激活,這可能與全能性基因擁有短而少的內含子的獨特基因特征有關,但是更詳細的機製還需要繼續探索🛌🏻。
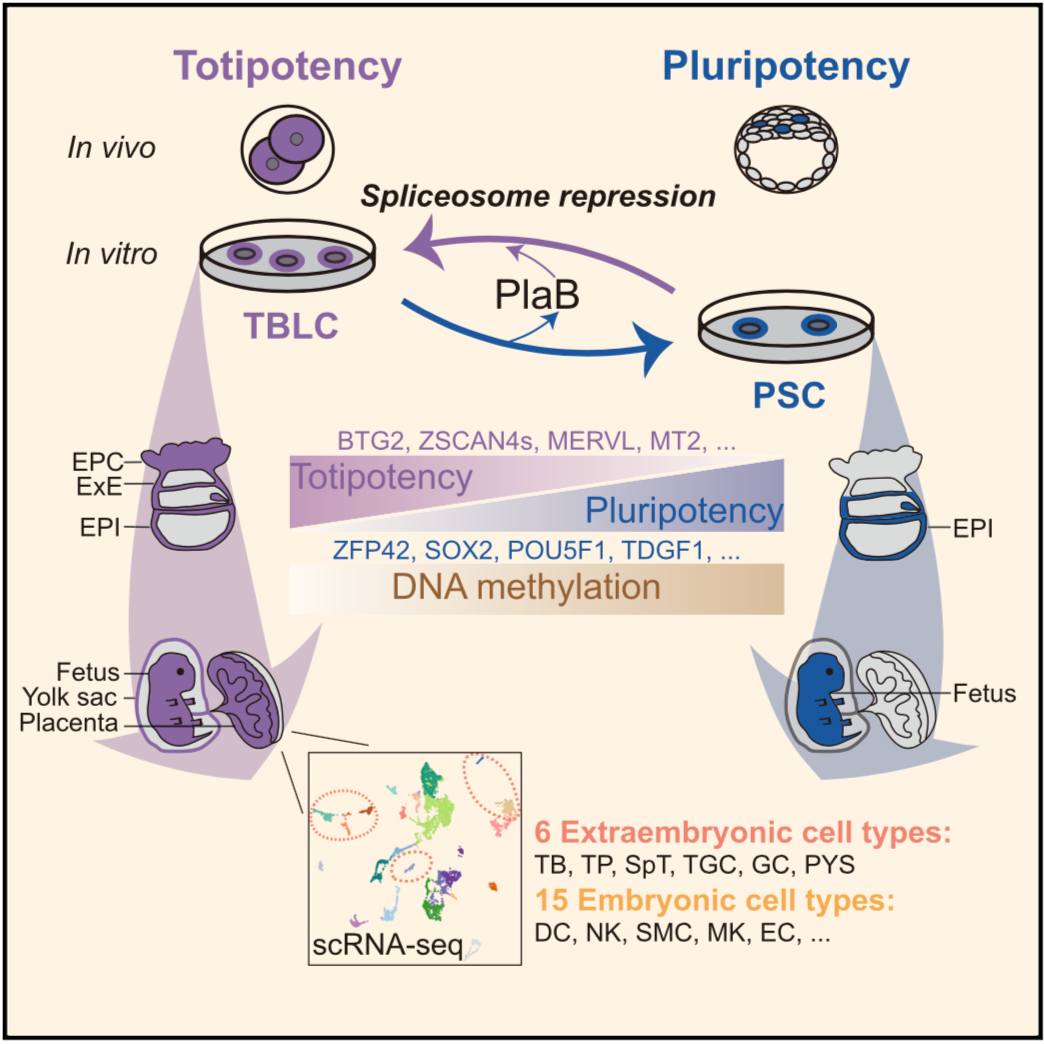
綜上,這項研究首次建立了體外捕獲和培養全能性幹細胞的方法,而且令人驚奇的揭示了剪接體在幹細胞命運轉變中的重要決定作用。故此,該成果不但對於早期胚胎發育相關的基礎研究提供了新的體外研究體系,同時也為未來幹細胞相關的臨床醫學研究提供了新型的發育潛能極高的“種子細胞”來源。
杜鵬為該論文的通訊作者。意昂体育平台前沿交叉學科研究院博士生申輝🌞、生命科學學院博士生楊敏和前沿交叉學科研究院博士生李詩雨為本文的並列第一作者。清華大學生命科學學院張靜、常在🎂,意昂体育平台博士生彭冰、汪春暉和博士後翁健莉對本文有重要貢獻🫅🏻🛗。該項目得到了國家自然科學基金、意昂体育平台“細胞增殖與分化”教育部重點實驗室、意昂体育-清華生命科學聯合中心的資助。
參考文獻𓀍:
1 Macfarlan, T.S., Gifford, W.D., Driscoll, S., Lettieri, K., Rowe, H.M., Bonanomi, D., Firth, A., Singer, O., Trono, D., and Pfaff, S.L. (2012). Embryonic stem cell potency fluctuates with endogenous retrovirus activity. Nature 487, 57–63.
2 Yang, J., Ryan, D.J., Wang, W., Tsang, J.C., Lan, G., Masaki, H., Gao, X., An- tunes, L., Yu, Y., Zhu, Z., et al. (2017a). Establishment of mouse expanded po- tential stem cells. Nature 550, 393–397.
3Yang, Y., Liu, B., Xu, J., Wang, J., Wu, J., Shi, C., Xu, Y., Dong, J., Wang, C., Lai, W., et al. (2017b). Derivation of Pluripotent Stem Cells with In Vivo Embry- onic and Extraembryonic Potency. Cell 169, 243–257.e25.
4Posfai, E., Schell, J.P., Janiszewski, A., Rovic, I., Murray, A., Bradshaw, B., Ya- makawa, T., Pardon, T., El Bakkali, M., Talon, I., et al. (2021). Evaluating toti- potency using criteria of increasing stringency. Nat. Cell Biol. 23, 49–60.

